MolMed offre servizi su misura per progetti di terapia cellulare e genica, soddisfacendo le esigenze del cliente in termini di garanzia dei più alti standard clinici e commerciali per ATMP.
I nostri servizi includono il trasferimento tecnologico, sviluppo, scale up, automazione e validazione di processi di trasduzione RVV/LVV di cellule, così come la finalizzazione e realizzazione del Prodotto Medicinale. Contemporaneamente, MolMed offre lo sviluppo, qualifica e validazione di test analitici, sia standard che prodotto-specifici. Abbiamo qualificato, validato ed internalizzato più di 100 test analitici per la caratterizzazione e il rilascio dei prodotti. MolMed è inoltre in grado di assistere i suoi clienti offrendo processi proprietari per la manipolazione cellulare di HSC (CD34+) e linfociti T.
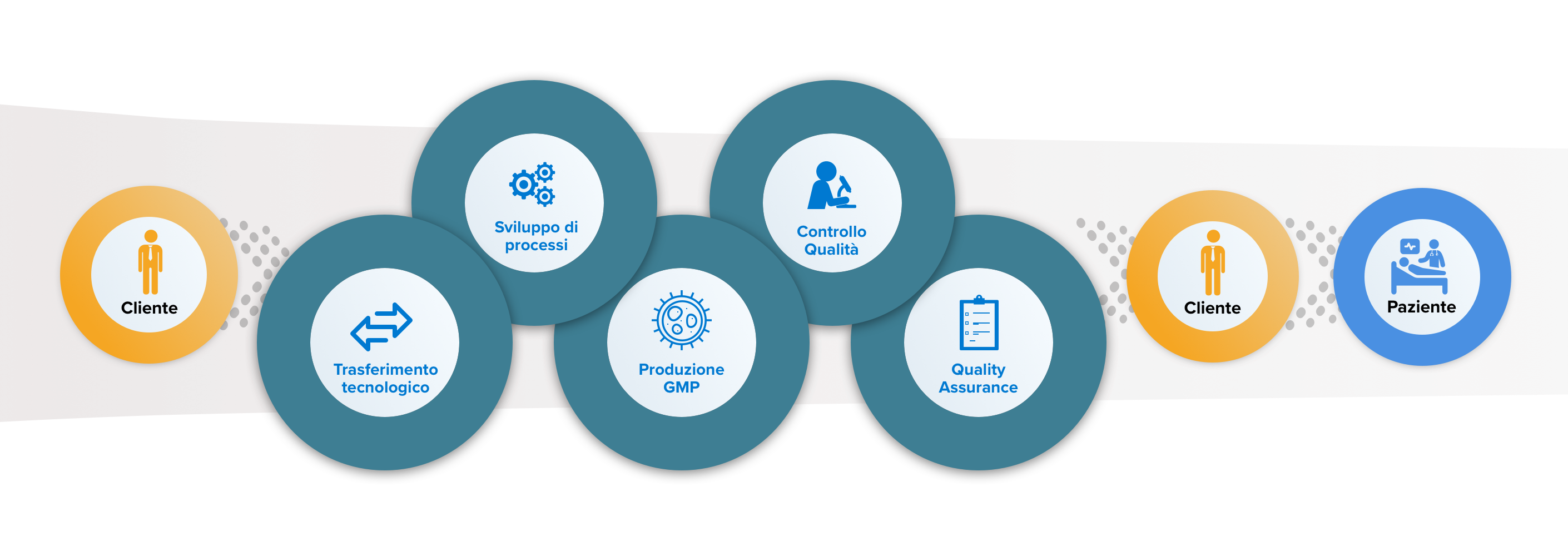
Trasferimento tecnologico
Offriamo processi proprietari per la trasduzione di cellule staminali ematopoietiche e linfociti T. In alternativa, possiamo internalizzare e sviluppare i processi del cliente per prodotti sia clinici sia commerciali.
Sviluppo di processi e Sviluppo di metodi analitici
La nostra unità di sviluppo dei processi ha eseguito diverse attività di trasferimento tecnologico, sviluppo, scalabilità, automazione e convalida di processi per piattaforme di trasduzione sia di proprietà che del cliente.
GMP Manufacturing
Eseguiamo trasduzioni di cellule staminali ematopoietiche e linfociti T, sia per prodotti autologhi che per prodotti allogenici. Le nostre strutture sono approvate dalle Autorità Italiane per la produzione di prodotti sia clinici sia commerciali.
Controllo Qualità
Possiamo offrire oltre 100 test eseguiti internamente tra cui safety, identità, potenza, purezza su IPC e DS/DP, con conseguente risparmio di tempo e costi. Il percorso di rilascio è finalizzato dai nostri QP interni.
QA e Supporto Regolatorio
Il nostro sistema di gestione della Qualità è in linea con le linee guida EU ATMP GMP e FDA (Food and Drug Administration). Offriamo inoltre supporto per consulenze scientifiche a organismi nazionali e internazionali, compresa la documentazione per Pre-IND, IND, IMPD e trial clinici, Orphan Drug Designation e per l'autorizzazione all'immissione in commercio (e equivalenti).




